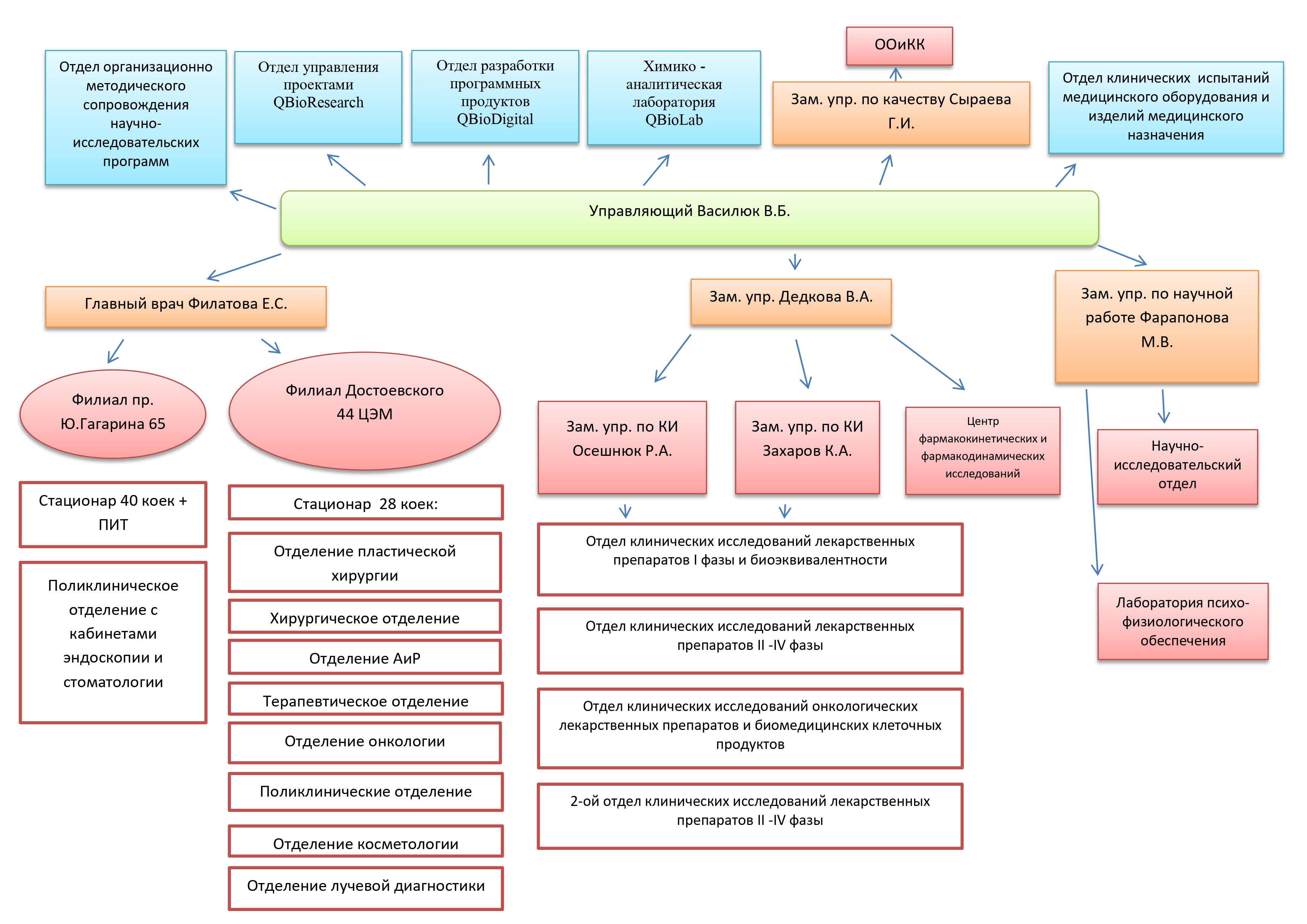
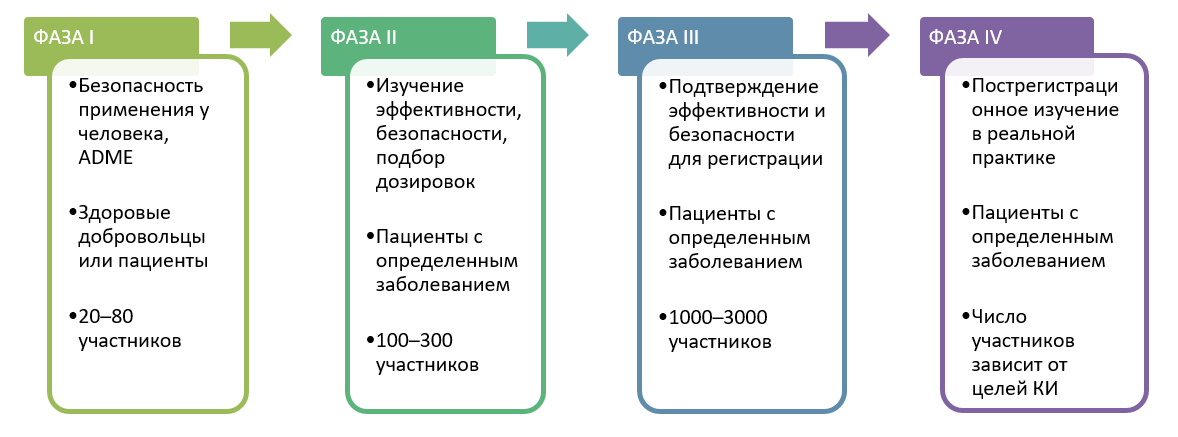
Создание лекарственных препаратов Шаг 7: Фаза 2 — Проверка правильности концепции
Информационно-правовая система нормативных правовых актов Республики Казахстан. Коллегия Евразийской экономической комиссии в соответствии со статьей 30 Договора о Евразийском экономическом союзе от 29 мая года, статьей 6 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря года, а также в целях обеспечения применения единых подходов к фармацевтической разработке, оценке качества и проведению фармакокинетических и клинических исследований биоэквивалентности отдельных групп лекарственных препаратов. Председатель Коллегии Евразийской экономической комиссии М.
&hide_Cookie=yes)

&hide_Cookie=yes)

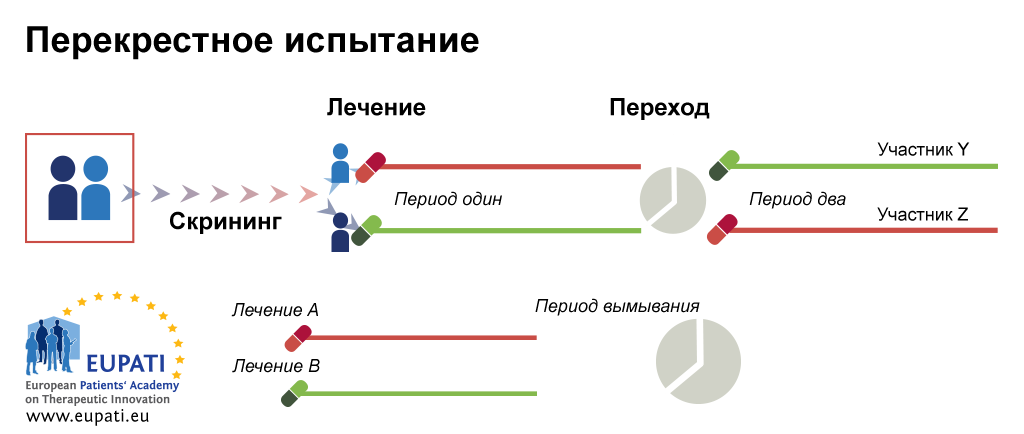
В соответствии с пунктом 2 статьи 4 и статьей 6 Соглашения о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря года и пунктом 86 приложения N 1 к Регламенту работы Евразийской экономической комиссии, утвержденному Решением Высшего Евразийского экономического совета от 23 декабря г. Внести в Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза, утвержденные Решением Совета Евразийской экономической комиссии от 3 ноября г. N 85 , изменения согласно приложению. Настоящее Решение вступает в силу по истечении календарных дней с даты его официального опубликования. Абзац второй пункта 4 дополнить предложением следующего содержания: "Разработка дизайна и проведение исследований, анализ данных сравнительной биодоступности для подтверждения биоэквивалентности лекарственных препаратов в лекарственных формах, предназначенных для оказания местного действия или для местного применения, проводятся в соответствии с требованиями согласно приложениям N 11 —







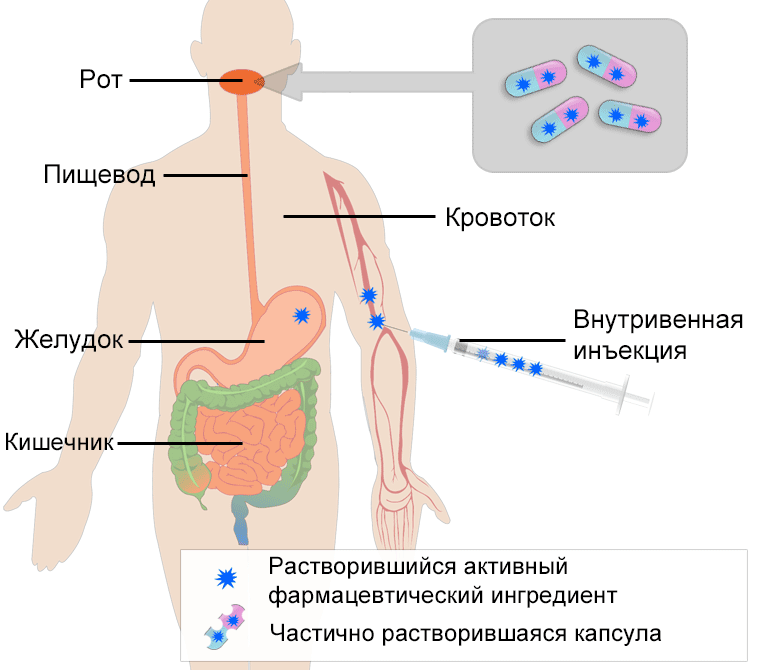

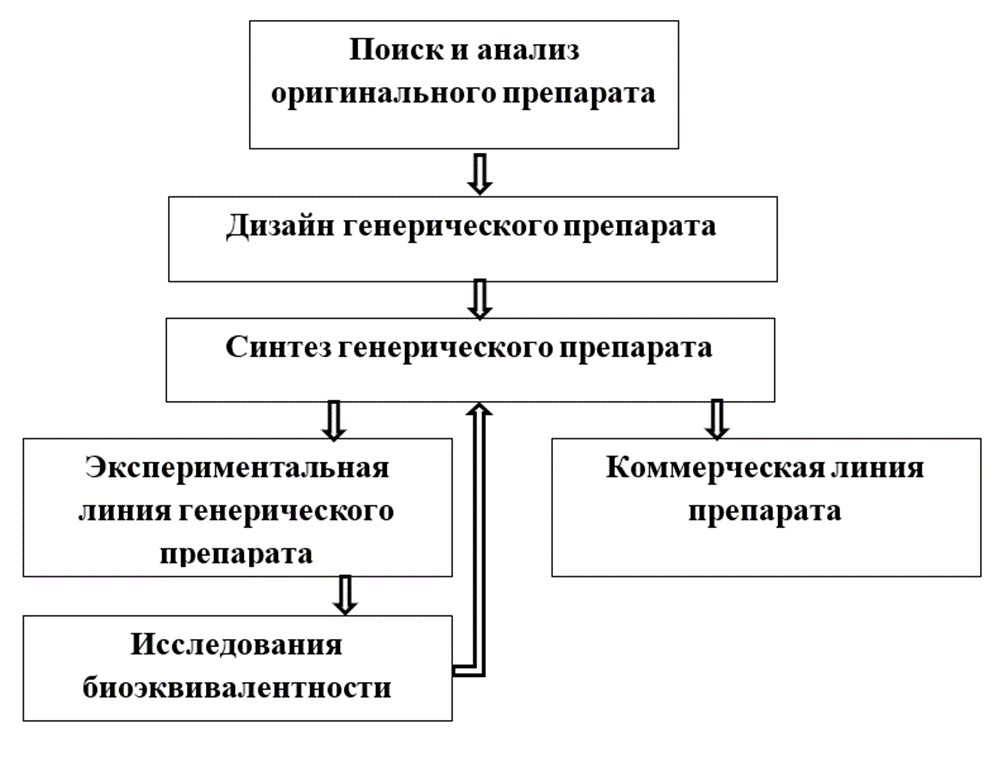


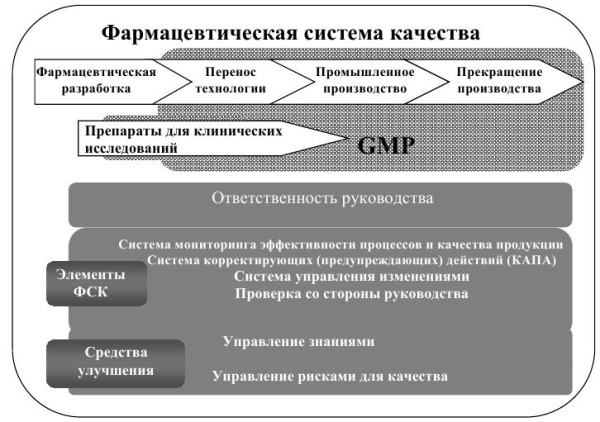
Магистерская программа «Фармацевтический анализ в производстве и контроле качества лекарственных средств» нацелена на получение обучающимися современных теоретических и экспериментальных знаний по синтезу, исследованию веществ и материалов; контролю качества лекарственных средств. В рамках полученных компетенций и квалификации выпускники могут выполнять работу и в других областях профессиональной деятельности, в том числе в сфере научно-технических, в сфере метрологии, сертификации и технического контроля качества сырья, полуфабрикатов и готовой продукции фармацевтической отрасли, в сфере химико-токсикологических исследований, а также в сфере оптимизации существующих и разработки новых технологий, методов и методик получения и анализа новых материалов и веществ. Выпускники программы могут работать в качестве сотрудников научно-образовательных организаций, лабораторий химической, биохимической, химико-фармацевтической промышленности; исследователей в научных и образовательных организациях. Программа призвана дать необходимые навыки для успешной работы в современной научной среде, сформировать универсальные, общепрофессиональные и профессиональные компетенции, необходимых для осуществления профессиональной деятельности химика в научно-исследовательской области, связанной с использованием химических явлений и процессов. Преподавание проводится в соответствии с международными стандартами надлежащих практик: GMP — надлежащая производственная практика и GLP — надлежащая лабораторная практика. Обучение производится ведущими представителями профессорско-преподавательского состава кафедр фармацевтической и токсикологической химии и органической химии РУДН.



&hide_Cookie=yes)